Lớp n có bao nhiêu Obitan? Tìm hiểu chi tiết
Trong hóa học, việc hiểu rõ cấu trúc nguyên tử và sự phân bố của các electron là rất quan trọng. Một trong những khái niệm cơ bản liên quan là số lượng obitan trong mỗi lớp electron. Bài viết này sẽ giúp bạn tìm hiểu về số lượng lớp n có bao nhiêu Obitan và ý nghĩa của nó trong hóa học.
Các khái niệm cơ bản
Trước khi trả lời câu hỏi về số lượng obitan trong một lớp n, chúng ta cần hiểu các khái niệm cơ bản liên quan đến cấu trúc nguyên tử:
Lớp electron
Lớp electron là các vùng không gian xung quanh hạt nhân của nguyên tử, nơi các electron có thể xuất hiện. Các lớp này được đánh số từ 1 đến n, trong đó n là số lượng lớp electron của nguyên tử.
Phân lớp electron
Mỗi lớp electron được chia thành các phân lớp, ký hiệu là s, p, d, f. Mỗi phân lớp có các đặc điểm và công thức khác nhau về số lượng obitan và số electron mà nó có thể chứa:
- Phân lớp s: Chứa 1 obitan.
- Phân lớp p: Chứa 3 obitan.
- Phân lớp d: Chứa 5 obitan.
- Phân lớp f: Chứa 7 obitan.
Obitan
Obitan là các vùng không gian trong phân lớp, nơi mà xác suất tìm thấy một electron là cao nhất. Mỗi obitan có thể chứa tối đa 2 electron, với các spin trái dấu (một spin lên và một spin xuống).
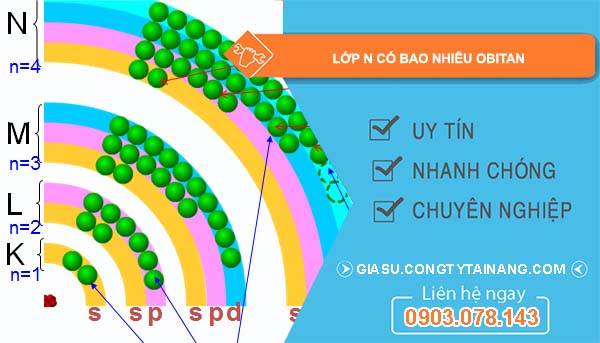
Lớp n có bao nhiêu Obitan
Lớp n có bao nhiêu Obitan? Lớp n trong nguyên tử có số lượng obitan khác nhau phụ thuộc vào giá trị của n và các số lượng phụ khác. Lớp n bao gồm các obitan có dạng s, p, d, f, và mỗi loại có một số lượng obitan riêng biệt. Cụ thể, lớp n có thể có tối đa n^2 obitan. Ví dụ, với lớp n = 1, chỉ có một obitan s; với lớp n = 2, có thể có hai obitan (s và p); lớp n = 3 có thể có 3 obitan (s, p và d), và lớp n = 4 có thể có tối đa 4 obitan (s, p, d và f).
Công thức để tính tổng số obitan trong lớp n là 2n^2. Điều này xuất phát từ việc mỗi obitan có thể chứa tối đa 2 electron, và mỗi loại obitan s, p, d, f có số lượng obitan khác nhau (1, 3, 5, 7 tương ứng). Vì vậy, số lượng obitan trong một lớp càng cao khi n càng lớn. Lượng obitan này cũng quyết định khả năng phân bố electron trong các lớp và mức năng lượng của nguyên tử.
Số lượng obitan trong lớp electron
Số obitan trong lớp electron thứ n được tính theo công thức: n² obitan. Mỗi lớp electron được ký hiệu từ K, L, M, N, … và mỗi lớp có một số lượng obitan nhất định, phụ thuộc vào chỉ số n. Cùng tìm hiểu chi tiết về lớp n có bao nhiêu Obitan.
Tổng kết số lượng obitan trong các lớp electron
Với các lớp electron từ K đến O, ta có thể tóm tắt số lượng obitan như sau:
- Lớp K (n = 1): 1 obitan
- Lớp L (n = 2): 4 obitan
- Lớp M (n = 3): 9 obitan
- Lớp N (n = 4): 16 obitan
- Lớp O (n = 5): 25 obitan.
Ý nghĩa của số lượng obitan trong mỗi lớp
Việc hiểu rõ số lượng obitan trong mỗi lớp electron giúp chúng ta hình dung được cách mà các electron phân bố trong nguyên tử và ảnh hưởng đến tính chất của nguyên tố đó. Các obitan này đóng vai trò quan trọng trong việc xác định cấu trúc hóa học của nguyên tử, cũng như cách các electron tương tác trong các phản ứng hóa học.
Cấu trúc các lớp và phân lớp electron cũng là cơ sở để hiểu các hiện tượng như độ bền của các liên kết hóa học, tính acid-bazơ của các hợp chất, hay sự hình thành các ion trong phản ứng hóa học.
Kết luận, việc xác định số lượng lớp n có bao nhiêu Obitan giúp chúng ta hiểu rõ hơn về cấu trúc phân lớp của các electron trong nguyên tử. Đây là kiến thức cơ bản, quan trọng trong hóa học và vật lý học, giúp giải thích nhiều hiện tượng khoa học, từ lý thuyết đến ứng dụng thực tiễn.