Lớp M có bao nhiêu orbital? Tìm hiểu chi tiết
Lớp M trong cấu trúc electron của nguyên tử có sự phân bố các orbital rất đặc biệt. Để hiểu rõ hơn về số lượng lớp M có bao nhiêu orbital, bài viết này sẽ giúp bạn khám phá cấu trúc của lớp này, từ đó nắm bắt được những kiến thức cơ bản về vật lý và hóa học.
Khái niệm Orbital là gì?
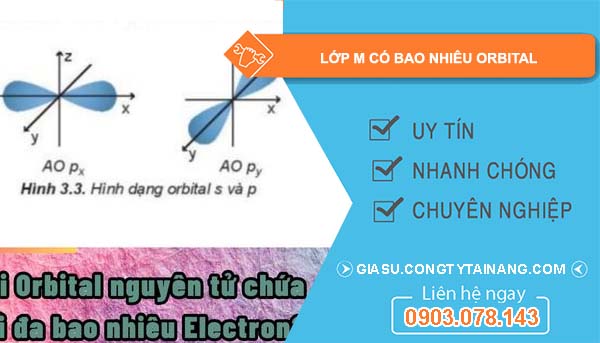
Orbital là một khái niệm trong cơ học lượng tử, được sử dụng để thay thế cho khái niệm quỹ đạo trong cơ học cổ điển và mô hình nguyên tử sơ khai. Nó mô tả hình dạng của phân bố xác suất mà tại đó electron có thể được tìm thấy trong nguyên tử. Các electron chuyển động xung quanh hạt nhân, tạo ra những mẫu hình phức tạp, thay vì di chuyển theo quỹ đạo xác định như trong mô hình cổ điển.
Cấu trúc của lớp M trong nguyên tử
Lớp M có 32 = 9 obitan gồm 1 obitan 3s, 3 obitan 3p và 5 obitan 3d. + Lớp L có 42 = 16 obitan gồm 1 obitan 4s, 3 obitan 4p, 5 obitan 4d và 7obitan 4f.. Mỗi loại orbital có một hình dạng và khả năng chứa một số electron khác nhau, tạo nên sự đa dạng trong cách phân bố electron trong nguyên tử.
Lớp M có bao nhiêu orbital
Lớp M có bao nhiêu orbital? Lớp M (n = 3) là lớp vỏ thứ ba trong cấu trúc của nguyên tử, và nó bao gồm ba phân lớp: 3s, 3p, và 3d. Mỗi phân lớp này chứa một số lượng orbital nhất định. Cụ thể, phân lớp 3s có một orbital, phân lớp 3p có ba orbital, và phân lớp 3d có năm orbital. Tổng số lượng orbital trong lớp M được tính bằng cách cộng số orbital của các phân lớp lại với nhau: 1 (từ phân lớp 3s) + 3 (từ phân lớp 3p) + 5 (từ phân lớp 3d).
Vì vậy, tổng số orbital trong lớp M là 1 + 3 + 5 = 9 orbital. Những orbital này có thể chứa electron theo các mức năng lượng khác nhau. Mỗi orbital có thể chứa tối đa hai electron, theo nguyên lý Pauli về nguyên lý bất định, vì vậy lớp M có thể chứa tổng cộng 18 electron. Tuy nhiên, số lượng orbital là 9, mỗi orbital có một vai trò quan trọng trong việc xác định cấu trúc điện tử của nguyên tử.
Ý nghĩa của các orbital trong lớp M đối với cấu trúc nguyên tử
Các orbital trong lớp M (n = 3) đóng vai trò quan trọng trong việc xác định cấu trúc và tính chất của nguyên tử. Lớp M bao gồm ba phân lớp: 3s, 3p và 3d, với tổng cộng 9 orbital. Mỗi orbital có một hình dạng và chức năng riêng biệt, ảnh hưởng đến cách electron phân bố trong nguyên tử, từ đó quyết định các đặc điểm hóa học và vật lý của nguyên tử đó.
Phân lớp 3s có một orbital, có hình dạng hình cầu và có thể chứa tối đa 2 electron. Đây là orbital đầu tiên mà electron sẽ điền vào khi nguyên tử có đủ năng lượng để kích thích electron lên lớp M. Phân lớp 3p có ba orbital, có hình dạng hình nón, có thể chứa tối đa 6 electron. Các orbital này nằm ở mức năng lượng cao hơn 3s, và chúng có vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tử, đặc biệt là trong việc hình thành các liên kết hóa học.
Cuối cùng, phân lớp 3d có năm orbital, có hình dạng phức tạp hơn và có thể chứa tối đa 10 electron. Mặc dù không phải tất cả các nguyên tử trong lớp M đều sử dụng hết các orbital 3d, nhưng các orbital này đóng vai trò quan trọng trong việc hình thành các liên kết trong các nguyên tử kim loại và các nguyên tử có số lượng electron lớn hơn.
Ý nghĩa của các orbital trong lớp M không chỉ dừng lại ở việc phân bố electron mà còn quyết định các đặc tính hóa học của nguyên tử, như tính oxy hóa, khả năng liên kết và tính chất vật lý như độ dẫn điện, độ cứng và màu sắc của các hợp chất. Cấu trúc orbital trong lớp M, cùng với các lớp vỏ bên ngoài, tạo nên nền tảng cho các phản ứng hóa học và sự hình thành các hợp chất phức tạp trong tự nhiên.
Gia sư Tài Năng có đội ngũ giáo viên dạy môn Hóa các lớp tại nhà hiệu quả và uy tín
Gia sư Tài Năng tự hào sở hữu đội ngũ giáo viên dạy môn Hóa với trình độ chuyên môn cao, kinh nghiệm giảng dạy phong phú và phương pháp giảng dạy hiệu quả. Chúng tôi cam kết mang đến cho học sinh những giờ học chất lượng, giúp các em hiểu sâu kiến thức Hóa học từ cơ bản đến nâng cao. Các giáo viên của Gia sư Tài Năng đều là những người tốt nghiệp từ các trường đại học danh tiếng, có chứng chỉ giảng dạy và nhiều năm kinh nghiệm giảng dạy môn Hóa. Đặc biệt, mỗi giáo viên đều có khả năng truyền đạt kiến thức một cách dễ hiểu, giúp học sinh phát triển tư duy logic và khả năng giải quyết vấn đề một cách nhanh chóng và chính xác.
Với phương pháp giảng dạy linh hoạt, Gia sư Tài Năng thiết kế các bài học phù hợp với nhu cầu và trình độ của từng học sinh. Các bài học được xây dựng theo chương trình học chuẩn của Bộ Giáo dục và Đào tạo, kết hợp với các tài liệu tham khảo phong phú, giúp học sinh nâng cao kiến thức và kỹ năng giải bài tập một cách hiệu quả. Đội ngũ gia sư của chúng tôi luôn chú trọng đến việc tạo dựng môi trường học tập thoải mái, khuyến khích sự chủ động và sáng tạo của học sinh.
Gia sư Tài Năng cam kết không chỉ giúp học sinh nâng cao điểm số trong các kỳ thi, mà còn giúp các em yêu thích môn Hóa học, phát triển đam mê nghiên cứu khoa học. Chúng tôi luôn hướng đến mục tiêu mang lại sự hài lòng tuyệt đối cho học sinh và phụ huynh thông qua chất lượng giảng dạy uy tín và hiệu quả.
Kết luận
Tóm lại, lớp M (n = 3) bao gồm ba phân lớp 3s, 3p và 3d, với tổng cộng 9 orbital. Mỗi orbital có một vai trò quan trọng trong việc phân bố electron, ảnh hưởng đến cấu trúc và tính chất của nguyên tử. Việc hiểu rõ số lượng và đặc điểm của các orbital trong lớp M không chỉ giúp học sinh nắm vững kiến thức Hóa học, mà còn hỗ trợ trong việc giải quyết các bài tập và bài kiểm tra. Gia sư Tài Năng hy vọng bài viết lớp M có bao nhiêu orbital giúp các bạn hiểu thêm về cấu trúc nguyên tử và nâng cao khả năng học tập môn Hóa.