e là gì trong Hóa học? tìm hiểu ý nghĩa
Gia sư Tài Năng xin chào các bạn yêu thích môn Hóa học! Trong bài viết này, chúng tôi sẽ giải đáp câu hỏi “e là gì trong Hóa học?” – một ký hiệu quan trọng thường xuất hiện trong các công thức và phản ứng. Hãy cùng khám phá để hiểu rõ ý nghĩa của nó nhé!
e (Electron) là gì trong Hóa học?
Electron là một trong ba loại hạt cơ bản trong nguyên tử, bên cạnh proton và neutron. Mặc dù proton mang điện tích dương và neutron không mang điện tích, electron lại mang điện tích âm và đóng vai trò cực kỳ quan trọng trong hóa học.
Electron có khối lượng khoảng 9.11 × 10⁻³¹ kg, chỉ bằng một phần rất nhỏ so với khối lượng của proton và neutron nhưng chúng lại quyết định các tính chất hóa học và tương tác của nguyên tử trong các phản ứng hóa học. Mặt khác, electron mang điện tích âm với độ lớn bằng với điện tích dương của proton, nhưng có dấu âm. Độ lớn của điện tích này là 1.602 × 10⁻¹⁹ coulomb.
Điện tích âm của electron rất quan trọng trong việc tạo ra các liên kết hóa học và tương tác giữa các nguyên tử. Mặc dù khối lượng của electron rất nhỏ, nhưng vai trò của nó trong các phản ứng hóa học lại rất lớn, vì các phản ứng này chủ yếu liên quan đến sự di chuyển hoặc chia sẻ electron giữa các nguyên tử.
Cấu trúc nguyên tử và vai trò của electron
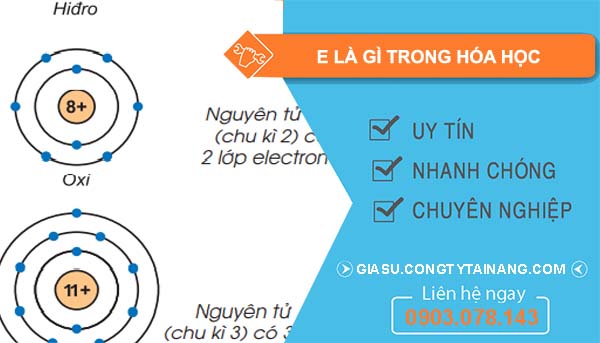
Nguyên tử, đơn vị cơ bản của tất cả các chất, bao gồm ba loại hạt: proton, neutron và electron. Các proton và neutron nằm ở hạt nhân của nguyên tử, trong khi electron di chuyển xung quanh hạt nhân trong các quỹ đạo gọi là “lớp electron” hoặc “vỏ electron”. Các lớp electron này phân chia thành các mức năng lượng khác nhau, với mỗi lớp chứa một số lượng electron nhất định.
- Proton: Mang điện tích dương, nằm ở trung tâm của nguyên tử (hạt nhân).
- Neutron: Không mang điện tích, cũng nằm trong hạt nhân và có khối lượng gần bằng proton.
- Electron: Mang điện tích âm, di chuyển xung quanh hạt nhân trong các lớp electron.
Cấu trúc nguyên tử có thể được mô phỏng như một hệ thống các lớp vỏ, mỗi lớp có một số lượng electron nhất định. Các lớp này được ký hiệu từ K (lớp gần hạt nhân nhất) đến Q (lớp xa nhất). Số lượng electron tối đa có thể có trong mỗi lớp phụ thuộc vào công thức 2n², trong đó n là số thứ tự của lớp electron.
Ví dụ:
- Lớp K có tối đa 2 electron.
- Lớp L có tối đa 8 electron.
- Lớp M có tối đa 18 electron.
- Lớp N có tối đa 32 electron.
Vai trò của electron trong liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử để tạo ra các phân tử hoặc hợp chất. Mối liên kết giữa các nguyên tử này chủ yếu được hình thành nhờ sự chia sẻ hoặc trao đổi electron. Có ba loại liên kết hóa học chính mà electron tham gia:
- Liên kết ion: Là liên kết hình thành khi một nguyên tử cho đi electron để tạo thành ion dương (cation), trong khi nguyên tử khác nhận electron để tạo thành ion âm (anion). Lực hút tĩnh điện giữa các ion dương và ion âm giữ chúng lại với nhau, tạo ra một liên kết ion. Ví dụ, trong hợp chất NaCl (muối ăn), natri (Na) mất một electron để trở thành Na⁺, còn clo (Cl) nhận một electron để trở thành Cl⁻. Liên kết giữa Na⁺ và Cl⁻ là liên kết ion.
- Liên kết cộng hóa trị: Đây là loại liên kết khi hai nguyên tử chia sẻ electron với nhau để đạt được cấu hình electron bền vững, thường là giống với cấu hình của khí hiếm (tức là đạt được 8 electron ở lớp ngoài cùng, gọi là quy tắc octet). Liên kết này thường xảy ra giữa các nguyên tử phi kim. Ví dụ, trong phân tử nước (H₂O), mỗi nguyên tử oxy chia sẻ một electron với hai nguyên tử hydro, tạo ra hai liên kết cộng hóa trị.
- Liên kết kim loại: Trong các kim loại, electron không thuộc về một nguyên tử cụ thể mà di chuyển tự do giữa tất cả các nguyên tử. Điều này tạo ra một “biển electron” chung mà các ion kim loại được bao quanh. Liên kết kim loại giúp giải thích tính dẻo và tính dẫn điện của kim loại.
Electron trong các phản ứng hóa học
Trong các phản ứng hóa học, các nguyên tử tương tác với nhau thông qua sự chuyển giao hoặc chia sẻ electron. Các phản ứng hóa học có thể được phân loại theo các cách thức mà electron tham gia:
- Phản ứng oxi hóa – khử: Đây là loại phản ứng trong đó có sự chuyển giao electron. Oxi hóa là quá trình mà một nguyên tử mất electron, trong khi khử là quá trình mà một nguyên tử nhận electron. Ví dụ, trong phản ứng giữa kẽm và axit clohiđric (HCl), kẽm mất electron để trở thành ion kẽm (Zn²⁺), trong khi ion H⁺ nhận electron và trở thành khí hydro (H₂).
- Phản ứng axit – bazơ: Trong phản ứng axit-bazơ, electron cũng tham gia vào quá trình chia sẻ. Axit là chất cho đi proton (H⁺), trong khi bazơ là chất nhận proton. Tuy nhiên, trong một số phản ứng axit-bazơ, electron còn có thể được trao đổi hoặc chia sẻ, ảnh hưởng đến mức độ axit hoặc bazơ của các chất tham gia phản ứng.
Kết luận
Electron, mặc dù có khối lượng rất nhỏ, lại có vai trò cực kỳ quan trọng trong hóa học. Chúng quyết định các tính chất hóa học của nguyên tử, ảnh hưởng đến cách các nguyên tử liên kết với nhau và tham gia vào các phản ứng hóa học. Liên kết hóa học, từ liên kết ion, cộng hóa trị đến kim loại, đều liên quan đến sự tương tác của electron giữa các nguyên tử. Sự di chuyển và phân bố của electron trong các lớp vỏ electron của nguyên tử quyết định khả năng của nguyên tử trong việc tạo ra các liên kết và tham gia vào các phản ứng hóa học.
Đây là bài viết chia sẻ e là gì trong Hóa học của Tài Năng, nhằm cung cấp những kiến thức quan trọng về hạt cơ bản này. Hy vọng bài viết sẽ mang lại những thông tin hữu ích và giúp bạn đọc nâng cao hiểu biết về thế giới vi mô trong khoa học hóa học.